
1921年的冬天,一種含有大量沉淀物的混濁淺棕色液體在多倫多大學(xué)面世,這是世界上第一份可用于人體的純凈胰島素,無數(shù)糖尿病患者的命運(yùn)就此被改寫。
而在100多年后,細(xì)胞療法再次吹響攻克糖尿病的號角,繼首個針對1型糖尿病的同種異體(供體)胰島細(xì)胞療法Lantidra被FDA批準(zhǔn)上市后,天津市第一中心醫(yī)院與北京大學(xué)干細(xì)胞中心于6日宣布:國際首例化學(xué)重編程誘導(dǎo)多潛能干細(xì)胞(CiPSC)分化的胰島樣細(xì)胞移植手術(shù)完成。
一名有著11年病史,依賴胰島素生活的1型糖尿病患者在接受細(xì)胞移植后,空腹C肽由移植術(shù)前的<0.02ng/ml上升至0.31ng/ml,移植后第10天,每日胰島素需要量已經(jīng)降低至移植前的一半!而隨著移植的胰島細(xì)胞進(jìn)一步獲得功能成熟,這一數(shù)字還有望再度刷新。
糖尿病治療已逐漸步入“細(xì)胞移植時代”,那么這一次,會是治愈的終章嗎?
全球首例——新iPSC技術(shù)治療糖尿病數(shù)據(jù)積極
胰島素是很多糖友們的“救命稻草”,但這項(xiàng)劃時代的發(fā)現(xiàn)并不是一場完美的醫(yī)學(xué)勝利。
原因是:注射胰島素只能為患者輸送控制血糖的”彈藥”,卻逆轉(zhuǎn)不了患者體內(nèi)胰島β細(xì)胞衰竭、死亡的事實(shí),一旦停藥,體內(nèi)胰島素會再次枯竭,讓糖尿病卷土重來。換而言之,胰島素?zé)o法真正治愈糖尿病,它只是將后者轉(zhuǎn)變?yōu)橐环N需要長期與之斗爭的慢性疾病。
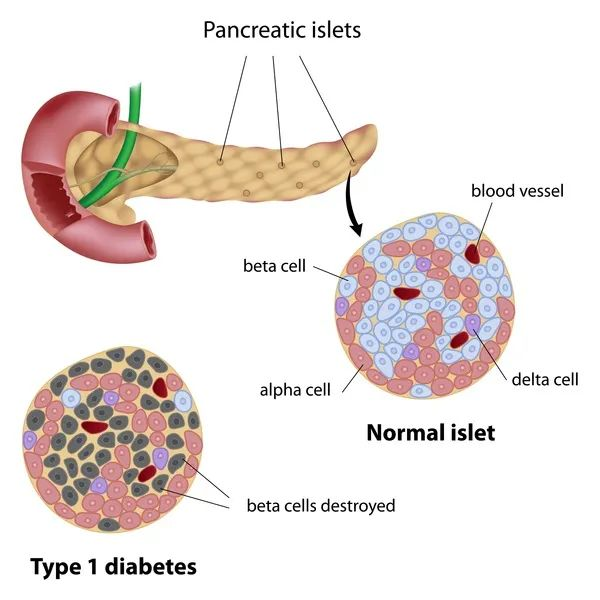
正常人可能想象不到這種漫長斗爭中的壓力與痛苦——日復(fù)一日的扎針,測血糖,望不到盡頭的賬單—據(jù)青少年糖尿病研究基金會2021年發(fā)布的數(shù)據(jù),1型糖尿病的平均終身治療成本為每人40萬美元。
這個數(shù)額足以把許多人攔在門外,但更讓人接受不了的是:即使有胰島素控制,也不是所有人都能逃過并發(fā)癥的厄運(yùn)。因此,直到今天,治愈糖尿病仍是很多研究者為之奮斗的目標(biāo)。
北京大學(xué)干細(xì)胞研究中心主任鄧宏魁也是其中一員,經(jīng)過多年的耕耘,其團(tuán)隊(duì)所發(fā)明的化學(xué)重編程誘導(dǎo)多潛能干細(xì)胞CiPSC可高效增殖、分化為結(jié)構(gòu)和功能與人原代胰島相似的人CiPSC分化胰島,有望替代糖尿病患者體內(nèi)衰竭死亡的胰島β細(xì)胞,成為治療糖尿病的全新方案。
iPSC技術(shù)我們都知道,那CiPSC技術(shù)又是什么呢?
廣義上來說,CiPSC也屬于iPSC的一種類型,只是誘導(dǎo)方式不同。它是除體細(xì)胞核移植和轉(zhuǎn)錄因子表達(dá)之外,第三種逆轉(zhuǎn)體細(xì)胞發(fā)育的方法——使用化學(xué)小分子將人成體細(xì)胞誘導(dǎo)為多潛能干細(xì)胞(人CiPS細(xì)胞),這一過程可簡稱為“化學(xué)重編程”。

這一由國內(nèi)團(tuán)隊(duì)自主研發(fā)的技術(shù),既不需要使用人卵母細(xì)胞,也不需要破壞人的早期胚胎,不但避免了細(xì)胞核移植存在的倫理問題、也突破了第二代技術(shù)(可能有基因突變的風(fēng)險),是人多潛能干細(xì)胞制備的全新途徑。
2022年,鄧宏魁研究組進(jìn)一步將hCiPSC定向誘導(dǎo)分化為胰島細(xì)胞(hCiPSC-islets),隨后這些hCiPSC-islets被注射到糖尿病模型猴腹直肌前鞘下,結(jié)果所有接受移植的糖尿病猴的血糖控制都得到了顯著改善,一只糖尿病猴C肽分泌水平甚至達(dá)到了健康水平。

這一研究結(jié)果極大地鼓勵了鄧宏魁與其研究團(tuán)隊(duì),是時候開展人體實(shí)驗(yàn)了!今年6月,他們與天津市第一中心醫(yī)院獲得國家干細(xì)胞臨床研究正式備案。
首位“吃螃蟹的勇者”是一名病史長達(dá)11年的1型“糖友”,在接受移植后當(dāng)天,她就已經(jīng)可以下床走動,經(jīng)檢測,胰島細(xì)胞存活良好,空腹C肽由移植術(shù)前的<0.02ng/ml上升至術(shù)后0.31ng/ml。而到了移植后的第10天,這位患者每日胰島素需要量已經(jīng)降低至移植前的一半,但血糖依舊穩(wěn)定,而隨著移植的胰島細(xì)胞在患者體內(nèi)進(jìn)一步得到功能成熟,治療效果也將在移植后數(shù)月內(nèi)逐漸達(dá)到穩(wěn)定狀態(tài)。這一研究結(jié)果證明著:CiPSC誘導(dǎo)胰島細(xì)胞移植有望成為治療1型糖尿病的理想方案,同時這項(xiàng)技術(shù)可應(yīng)用于伴有胰島功能衰竭的2型糖尿病患者。
從控糖到改善并發(fā)癥 糖尿病進(jìn)入細(xì)胞治療時代
2023年的夏季,糖尿病領(lǐng)域顯得尤為“炙熱”。
除了我國科學(xué)家的研究成果,老牌生物科技巨頭福泰制藥Vertex Pharmaceuticals于6月23日公布干細(xì)胞療法VX-880治療I型糖尿病的1/2期臨床數(shù)據(jù)——6名接受了VX-880治療的1型糖尿病患者,均在不同程度上恢復(fù)了胰島素分泌,血糖得到改善。

CellTrans公司的消息緊隨其后,其旗下研發(fā)的Lantidra(一款供體來源的胰島細(xì)胞制成的同種異體(供體)胰島細(xì)胞療法)已獲美國食品藥物監(jiān)督管理局(FDA)批準(zhǔn)上市。
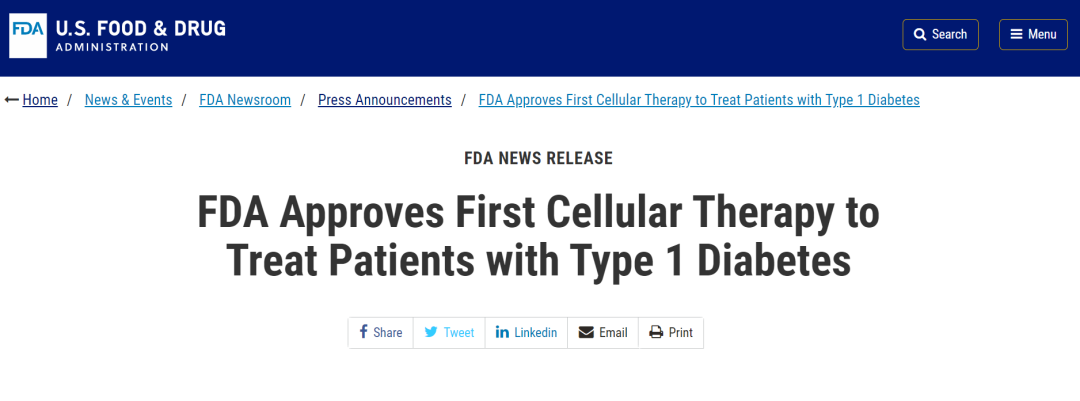
這款藥物是全球首個針對I型糖尿病患者的細(xì)胞療法,可治療即使接受繁復(fù)糖尿病治療和教育,仍然由于嚴(yán)重低血糖的反復(fù)發(fā)作,無法達(dá)到目標(biāo)糖化血紅蛋白水平的Ⅰ型糖尿病成人患者。
據(jù)臨床試驗(yàn)顯示:21名患者在接受治療后1年以上不需要服用胰島素,11名患者在接受治療后1~5年不需要胰島素,10名患者5年以上不需要胰島素。
接二連三的新聞快訊,似乎昭示著糖尿病治療將進(jìn)入一個全新的治療時代,更為重要的是,細(xì)胞療法或許會是一種潛在的“治愈型”療法。
它既不像口服降糖藥那般通過刺激殘存胰島細(xì)胞分泌胰島素來達(dá)到目的,也不是單純地補(bǔ)充體內(nèi)缺失的胰島素,而是從源頭出發(fā),去補(bǔ)充患者體內(nèi)所缺少的胰島β細(xì)胞,“歸還”患者自產(chǎn)胰島素的能力。
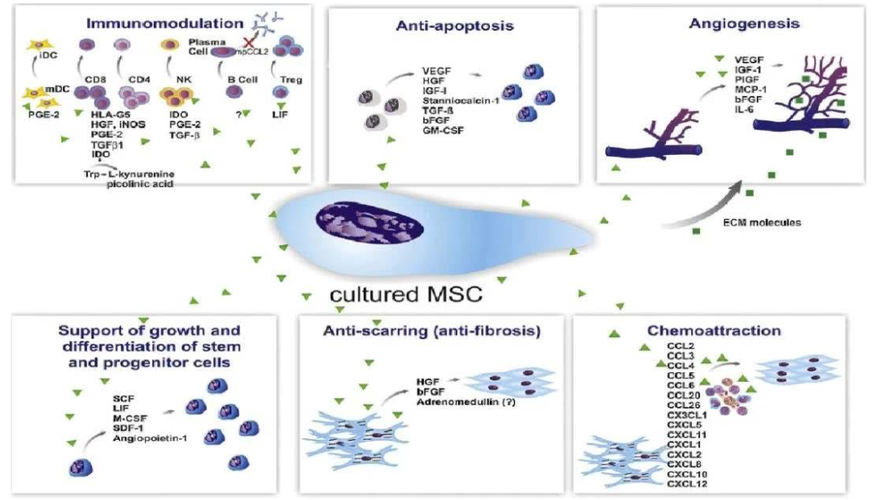
需要指出的是,細(xì)胞療法的作用還不止于控糖,以干細(xì)胞家族出鏡率較高的間充質(zhì)干細(xì)胞(MSCs)為例,它除了擁有多向分化與自我更新的能力,還兼具旁分泌效應(yīng)和免疫調(diào)節(jié)的功能,在對抗糖尿病并發(fā)癥上也擁有著不俗的前景。
據(jù)了解,糖尿病最常見的死因就是血管并發(fā)癥—長期處于高糖狀態(tài)下的血液,會不斷損害患者的血管內(nèi)皮,造成微血管病變(腎病、視網(wǎng)膜病變等)或大血管病變(動脈粥樣硬化、心臟病等),而后者讓患者更容易遭遇心臟衰竭、中風(fēng)、靜脈動脈血栓、心肌病等重大疾病。
面對這樣的生命健康威脅,《Stem Cell Research & Therapy》(影響因子:6.832)上的研究證實(shí),MSCs可以通過MAPK/ERK信號介導(dǎo)的旁分泌機(jī)制,顯著改善高糖誘導(dǎo)的細(xì)胞損傷,促進(jìn)人內(nèi)皮細(xì)胞(HUVECs)的細(xì)胞活力、傷口愈合、遷移和血管生成,是糖尿病血管并發(fā)癥臨床治療的前瞻性策略。
除此以外,一項(xiàng)研究還嘗試?yán)弥窘M織的間質(zhì)血管成分(SVF)細(xì)胞改善糖尿病足,SVF中包含內(nèi)皮祖細(xì)胞(EPC)和間充質(zhì)干細(xì)胞(MSC),兩者均具有促進(jìn)血管生成的活性,在對63例慢性糖尿病足患者治療后,加速了傷口愈合,80%患者傷口愈合率達(dá)100%。
我們可以看到細(xì)胞療法已經(jīng)吹響了“擺脫胰島素,告別并發(fā)癥”的號角,而隨著越來越多的研究證實(shí)細(xì)胞療法在糖尿病治療領(lǐng)域的有效性和安全性,我們期待著,糖友們能夠真正迎來糖尿病治療的新時代。
寫在最后
20世紀(jì)以前,人類對于糖尿病束手無策,橫空出世的胰島素挽救了萬千糖尿病患者的生命,但痛苦并沒有隨之消失,而是散落在糖友瑣碎的生活中,繼續(xù)折磨著他們。
研究者再次擔(dān)起了解救的重任,這些年,以干細(xì)胞為首的再生醫(yī)學(xué)正用振奮你我的數(shù)據(jù)與結(jié)果,讓擺脫胰島素成為可能。更讓國人興奮的是,我國科學(xué)家也在其中書寫著各類“中國首創(chuàng)”、“國際首例”,為實(shí)現(xiàn)科技強(qiáng)國、造福大眾貢獻(xiàn)著巨大力量。
參考文獻(xiàn)
天津市第一中心醫(yī)院,《天津市第一中心醫(yī)院聯(lián)合北京大學(xué)干細(xì)胞中心獲重大臨床突破!成功完成國際首例CiPSC誘導(dǎo)的胰島細(xì)胞移植》